2022年7月7日,中国医学科学院药物研究所“天然药物活性物质与功能”国家重点实验室蒋建东院士、王琰研究员为共同通讯作者,与吉林大学心血管中心佟倩教授合作在国际著名期刊signal transduction and targeted therapy(影响因子38.1)在线发表了“berberine treats atherosclerosis via a vitamine-like effect down-regulating choline-tma-tmao production pathway in gut microbiota”论文,首次阐明了小檗碱(bbr)以维生素样的作用下调肠道菌胆碱-tma-tmao代谢通路而改善动脉粥样硬化症的分子机制。
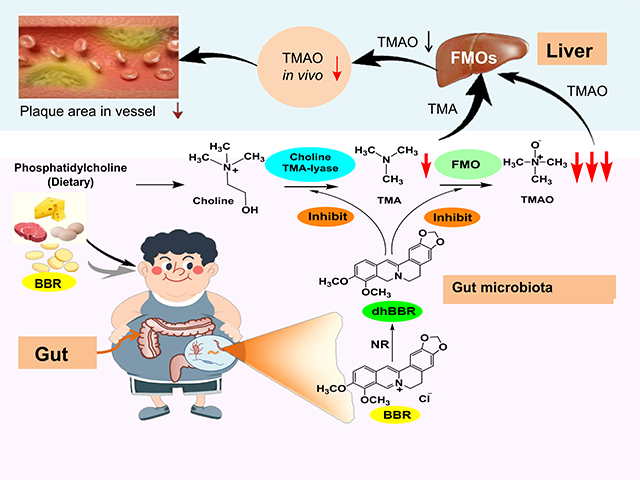
心血管疾病(cvd)是当前人类死亡的首要原因,而动脉粥样硬化(as)是cvd的病理基础。as的发病机制有多种危险因素和分子机制,如高血脂或高血糖、局部或全身炎症反应等。近年来,越来越多的证据表明,肠道菌是as发展和恶化的影响因素。其中,三甲胺(tma)是一种肠道菌衍生的代谢产物,通过分解摄入的红肉或动物内脏中的膳食磷脂酰胆碱/胆碱、左旋肉碱或甜菜碱而生成。被吸收入血的肠道tma被黄素单加氧酶家族成员(例如肝脏中的黄素单加氧酶3,fmo3)进一步转化为三甲胺-n-氧化物(tmao),促进了as斑块形成。最近的研究表明,与传统的危险因素不同,tmao是as的独立预测因子和促进剂。事实上,tmao通过多种机制加重as,包括增强对泡沫细胞形成的作用、血小板高反应性和血栓形成风险、直接激活炎症反应和干扰胆固醇的反向转运,因此,抑制肠道菌tmao的生成被认为是干预as疾病发生发展潜在的新靶点。
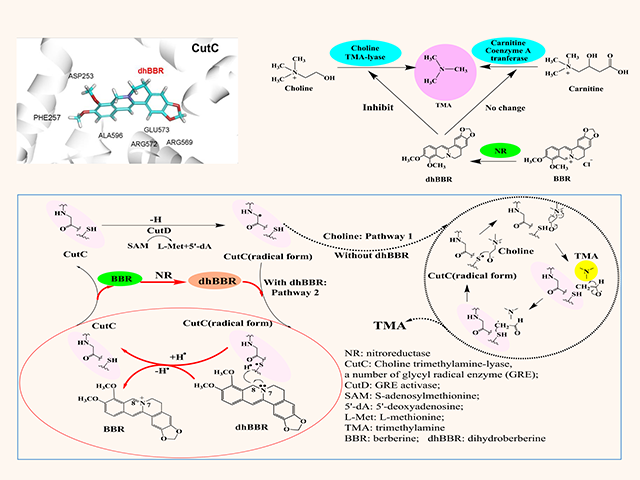
该研究首次揭示了as金黄地鼠口服bbr降低了肠道中tmao的生物合成。这种独特分子机制是通过小檗碱的代谢产物二氢小檗碱(dhbbr,一种肠道菌nr产生的还原型小檗碱)作用于肠道菌胆碱三甲胺裂解酶及辅酶(cutc/cutd)从而抑制了胆碱向tma的转化;同时,dhbbr也作用于肠道菌黄素单加氧酶及辅酶(fmo/fad),使tma向tmao转化被抑制,而dhbbr被氧化生成bbr。dhbbr与bbr相互转化,与维生素的作用方式相似(如维生素c与脱氢维生素c),最终下调了胆碱-tma-tmao代谢通路而改善as。该研究也进一步开展了临床21个高脂血症伴as患者口服bbr的试验,结果表明口服bbr四个月后斑块评分减少了3.2% (*p < 0.05),其粪便和血中tma 和tmao 含量分别降低了38%和 29%(粪便:*p < 0.05; *p < 0.05), 及37%和 35%(血:***p < 0.001; *p < 0.05)。结果证实,bbr可能作用于肠道菌cutc/cutd 及fmo/fad并以维生素样的作用方式减少肠道菌tmao的生物合成,从而改善as。本文是首次发现小檗碱通过作用肠道菌nr-cutc/cutd-fmo酶系改善as的药效及分子机制,并通过临床试验得到验证。该研究对天然药物(难吸收)体内代谢及分子药理的研究具有广泛的意义和重要的科学价值。
中国医学科学院医学与健康科技创新工程(no.2016-i2m-3-011,2021-i2m-1-007),nsfc(no. 81573493,82173888)和“创新药物非临床药物代谢及pk-pd研究”北京市重点实验室(z141102004414062)等资助了该研究。马殊荣(2016级直博生)、佟倩(吉林大学第一医院心血管中心,教授)、林媛副研究员、潘利斌(2017级直博生)和符洁助理研究员为共同第一作者。
原文链接:
